
스위스 노바티스의 세계 첫 키메릭항원수용체(CAR)-T세포 항암제 ‘킴리아’, 미국 버텍스와 크리스퍼테라퓨틱스의 유전자 편집 혈액질환 치료제 ‘카스게비’…. 글로벌 제약·바이오업계에 새 역사를 쓴 이들 신약은 대학에서 탄생했다. 킴리아 개발은 펜실베이니아대 의대에서, 카스게비는 스탠퍼드대 의대에서 주도했다. 한국에서도 ‘의대 신약 개발’의 장이 마련됐다. 올해 2월 개정 첨단재생의료·첨단바이오의약품 안전·지원에 관한 법률(첨생법)이 시행되면서다.
◇1년 새 재생 의료기관 47% 증가
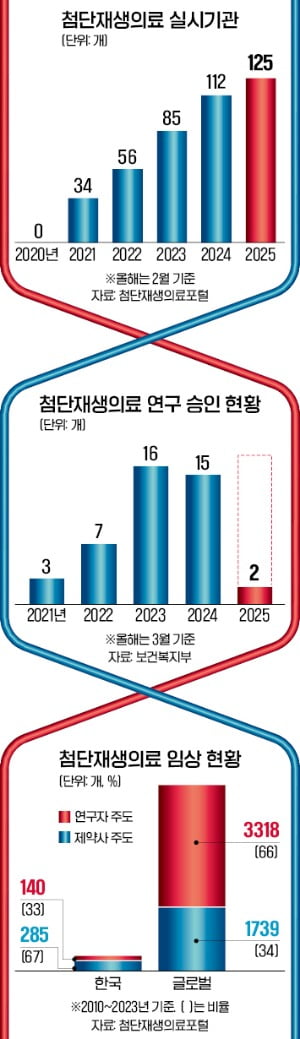
11일 보건복지부에 따르면 2023년 85개인 국내 첨단재생의료 실시기관은 올해 2월 125곳으로 1년여 만에 47% 증가했다. CAR-T는 물론이고 줄기세포 등 첨단재생치료를 하려면 병원은 실시기관 인증을 받아야 한다. 지난해 2월 개정 첨생법이 제정된 뒤 지난 2월 시행되자 일선 병원 수요가 급격히 커졌다는 의미다.
법 개정 이전에도 첨생법에 따라 일부 대학병원에서 희귀·난치질환자에게 고난도 세포·유전자 치료를 하는 연구는 이뤄졌다. 서울대병원 CAR-T가 첫 사례다. 2021년 12월 연구 승인을 받았다. 소아암 환자의 혈액 속 면역 T세포로 약을 만든 뒤 투여해 암을 없애는 치료다. 기존 20%였던 완치율을 60%로 높였다.
국내에 상용화된 킴리아는 환자 세포를 냉동해 미국까지 운반한 뒤 조작하고 다시 한국으로 가져온다. 이 과정만 두 달 넘게 걸린다. 서울대병원은 이를 12일로 단축했다. 세포 냉동과 해동 과정이 필요 없어 치료 효율을 높일 수 있다. 킴리아는 약값만 3억원 넘게 들지만 서울대병원의 CAR-T 제작 비용은 개당 수천만원이다. 아직은 연구 단계라 환자에게 돈을 받진 않는다. 조제비는 정부 연구개발(R&D) 비용, 고(故) 이건희 삼성그룹 명예회장 유족의 기부금 등으로 충당하고 있다. 개정법에 따라 연구 성과가 쌓여 치료 단계로 넘어가면 환자에게 일정 비용을 받고 병원에서 투여할 수 있다. 이후 기업 등에 기술을 이전하면 상업화도 가능하다. 강형진 서울대병원 교수는 “개정 첨생법 시행으로 병원 기반 세포·유전자 치료가 활성화될 수 있다”고 말했다.
◇줄기·연골 세포까지 연구 확대
국내 첨단재생의료는 서울대병원 CAR-T처럼 희소·난치 질환자의 세포와 유전자 등을 조작해 넣어주는 ‘고위험’, 타인 세포를 일부 조작해 넣어주는 ‘중위험’, 환자 세포를 단순 배양해 넣어주는 ‘저위험’ 등으로 나뉜다. 일본에서 시행하는 첨단재생의료는 70%가량이 저위험이다. 혈액 속 줄기세포 등을 배양해 넣어 몸속 회복력 등을 높이는 수준에 머무른다.
저위험 첨단재생의료는 신약 개발까지 이어가는 데 한계가 있다. 그동안 치료제가 없던 시장에서 약효를 입증해야 하는데 ‘단순 배양’만으론 이를 충족하기 힘들어서다.
3월 기준 국내에서 승인받은 첨단재생의료 연구 43건 중 33건(77%)이 중위험(17건)과 고위험(16건) 연구다. 저위험 연구는 10건(23%)에 그친다. 제도 시행 초기이기 때문에 아직 숫자가 많지 않지만 대학병원 등의 고위험 연구를 중심으로 첨단재생의료가 안착하고 있다는 평가가 나온다.
후속 연구에 뛰어드는 병원도 늘어나는 추세다. 최병옥 삼성서울병원 신경과 교수는 2023년부터 희소 유전질환인 샤르코마리투스 환자에게 국내 바이오 기업 이엔셀의 탯줄 유래 줄기세포 치료제(EN001)가 효과가 있는지 등을 확인하는 첨단재생의료 연구를 하고 있다. 주지현 서울성모병원 류마티스내과 교수는 무릎관절염 환자에게 국내 바이오 기업 입셀의 연골세포집합체(MIUChon)를 투여하는 연구를 지난해 시작했다.
이지현 기자 bluesky@hankyung.com

 3 days ago
7
3 days ago
7














 English (US) ·
English (US) ·