파킨슨병 알츠하이머병 췌장암 등 희소·난치 질환을 앓는 환자는 신약 임상이 종료된 이후 계속 치료를 원하는 경우가 많다. 이때 임상 책임연구자인 주치의가 치료목적 사용승인 절차를 밟아 추가로 투약할 수 있다. 하지만 식품의약품안전처가 새로운 규제를 추가해 환자의 치료 접근성을 떨어뜨리고 있다는 지적이 나온다.
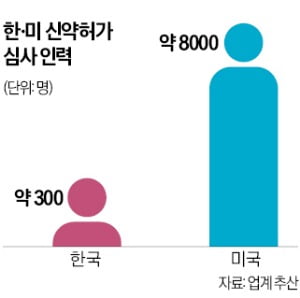
14일 제약업계에 따르면 식약처는 지난해 7월 임상시험 의약품의 치료목적 사용승인 관련 약사법령을 개정했다. 치료목적 사용승인은 생명을 위협하는 중대한 질환을 가진 환자를 치료하는 경우, 대체 치료 수단이 없는 환자를 치료하는 경우 등에 한해 임상시험 중인 의약품을 사용할 수 있도록 허가하는 제도다.
식약처가 제도를 개정한 배경은 희소·난치성 환자 등의 치료 기회를 확대하기 위해서다. 치료제가 없는 질병을 앓는 환자는 임상 중인 신약이 유일한 희망이기 때문이다. 하지만 업계는 개정안에 추가된 “동료의사 3명의 소견서를 받아야 한다”는 항목이 규제를 강화하는 효과를 내고 있다고 지적한다.
‘동료의사 3명’ 기준을 새로 둔 것은 이해상충을 해소한다는 이유에서다. 이들 동료의사는 주치의와 다른 의료기관 소속이며, 해당 신약의 임상에 참여하지 않은 전문의여야 한다. 미국 식품의약국(FDA)은 주치의 소견만 있으면 치료목적 사용을 승인하고 있다. 업계 관계자는 “동료의사는 자신이 치료하지 않은 환자에 대해 잘 알지 못할 뿐만 아니라 임상 중인 신약도 상세히 파악하기 힘들다”며 “환자에게 신약을 투약하기까지 기존보다 1~2개월 지체되고 있다”고 했다.
김유림 기자 youforest@hankyung.com

 6 hours ago
2
6 hours ago
2













 English (US) ·
English (US) ·