세계 세포·유전자치료제(CGT) 시장의 가파른 성장이 미국, 유럽연합(EU), 일본 등 주요 국가가 앞다퉈 지원책을 도입한 결과라는 평가가 나온다. 하지만 지원책 도입 후 눈에 띄는 성과가 나오기까지는 10년 가까이 걸려 꾸준한 지원과 관심이 필요한 것으로 나타났다.
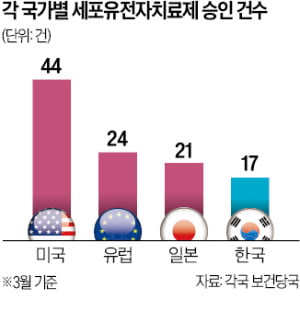
14일 업계에 따르면 현재까지 미국과 EU, 일본에서 허가된 세포·유전자치료제는 각각 44건, 24건, 21건이었다. 국내에서는 총 17개가 승인됐다. 가장 많은 세포·유전자치료제가 승인된 미국은 첨단재생치료법 개발을 가속화할 목적으로 2016년 첨단재생의료치료제(RMAT) 제도를 도입했다. RMAT로 지정되면 식품의약국(FDA) 신약 심사에서 우선순위를 부여해주고 각종 허가 절차도 간소화해준다. FDA 허가를 받아 나온 세포·유전자치료제 중 RMAT로 지정된 의약품은 총 13개다.
줄기세포기술의 ‘종주국’인 일본 또한 발 빠르게 첨단재생치료제 개발을 장려하기 위한 제도적인 근거를 마련했다. 2014년 ‘재생의료안전확보법’을 시행한 데 이어 2015년 ‘사키가케 제도’를 도입했다. 사키가케 제도는 세포 및 유전자치료제에 우선 심사 및 조기 승인을 보장하는 제도로 미국의 RMAT와 비슷하다.
다만 법 시행 후 결과가 나오기까지 10년 내외의 시간 차가 있었다. FDA 최종 문턱을 넘은 RMAT 지정 세포·유전자치료제 13개 중 10개의 승인 시점이 2023년 이후다. 일본에서는 사키가케 제도를 통해 3개가 승인된 것으로 알려져 있으며 모두 2020년 이후였다. 관련 제도가 생긴 뒤 미국은 약 7년, 일본은 5년 후에야 성과가 나오기 시작한 것이다.
유럽은 제도화 시점은 가장 빨랐다. 2007년 ‘첨단의료제품(ATMP)’ 법으로 CGT 규제를 마련했다. 하지만 실제 승인은 2016년 ‘프라임 메디신’ 제도를 도입한 뒤에야 본격화됐다. 유럽에서 승인된 CGT 24건 중 17건이 2020년 이후 허가를 받았다. 2020년대에 이르러 세포·유전자치료제 기술이 성숙되면서 앞서 지원책으로 토양을 닦은 국가 및 지역에서부터 성과가 나왔다는 설명이다. 국내 세포·유전자치료제 업체 관계자는 “국내에서도 개정 첨단재생의료법이 지난 2월 시행됐지만 가시적인 결과를 얻기까지는 수년이 걸릴 수 있다”고 말했다.
이우상 기자 idol@hankyung.com

 1 day ago
3
1 day ago
3
![강팀 올킬 '1황' 젠지...듀로의 '스텝 업' 빛났다 [이주현의 로그인 e스포츠]](https://img.hankyung.com/photo/202504/01.40169090.1.jpg)











 English (US) ·
English (US) ·